About the Author

Marjolein Van Egmond
Professor at Amsterdam UMC
Marjolein van Egmond’s laboratory studies antibody activation of innate myeloid immune cells, macrophages and neutrophils, with emphasis on understanding the role of immunoglobulin A (IgA) in physiology and pathology. Her groups research focuses specifically on (1) the contribution of abnormal antibody responses to chronic inflammation and autoimmunity – (2) monoclonal antibody therapy of cancer. Dr. van Egmond’s research is highly translational and she is cross appointment with the Department of Surgery and the Department of Molecular Cell Biology and Immunology, to facilitate the rapid progression of pre-clinical findings into clinical applications.
Her research is funded by The Dutch Cancer Society, Worldwide Cancer Research, MaagLeverDarm Foundation, Cancer Center Amsterdam Foundation and the Netherlands Organisation for Scientific Research (VENI; 2003, VIDI; 2007, ASPASIA; 2008, VICI; 2014, ASPASIA 2015).
Inhoud
Dit artikel is oorspronkelijk op 9 april gepubliceerd als flipbook-PDF, verluchtigd met speelse illustraties. Voor wie het swipen en scrollen hinderlijk vindt, heb ik snel een text-only versie gemaakt. De typografie is goed genoeg om de inhoud tot je te kunnen nemen. Er staan hier en daar nog illustratie-bijschriften en in de inhoudsopgave staan ook bijschriften. Die heb ik maar laten staan, met wat verbeeldingskracht kun je er zelf misschien wat bij bedenken en anders kijk je alsnog in het originele artikel.
SARS-CoV-2 is een nieuw virus voor mensen en COVID-19, de ziekte die het veroorzaakt, is een nieuwe ziekte. Veel is nog onbekend. Hoe besmettelijk is het virus in mensen van verschillende leeftijden en met verschillende stadia van de ziekte? Wat is het scala aan symptomen? Zijn er veel mensen die nauwelijks symptomen hebben? Hoe is de ziekte te behandelen? De wetenschappelijke ontdekkingen gaan snel en elke dag wordt er bijgeleerd. Toch is nog lang niet alles duidelijk. Wat vandaag wordt verteld, kan morgen net iets anders blijken te liggen als er weer nieuwe gegevens bekend zijn geworden.
De situatie wordt dagelijks nauwlettend in de gaten gehouden en op basis van de meest actuele wetenschappelijke kennis worden zo goed mogelijk modellen gemaakt om de voortgang van de pandemie te voorspellen. Deze voorspellingen zullen niet altijd volledig kloppen. Dit is logisch. Voor deze modellen moeten verschillende aannames worden gemaakt, zoals de besmettelijkheid en dodelijkheid van de ziekte. Ook voorspellen de modellen wat de effecten zijn van maatregelen (zoals thuisblijven en afstand van elkaar houden) op de verspreiding van de ziekte en het aantal mensen dat moet worden opgenomen in een ziekenhuis. Wanneer nieuwe kennis wordt opgedaan, kan achteraf blijken dat sommige van deze aannames niet precies klopten.
Hetzelfde geldt voor de maatregelen die de regering neemt op basis van deze modellen. Zoals minister-president Rutte eerder heeft gezegd, moet de regering ‘voor 100% procent besluiten nemen met slechts 50% informatie’.
De modellen helpen enorm bij de besluitvorming. Elke nieuwe fase van de ziekte en het aantal besmettingen per land, vraagt om andere maatregelen van de bevolking om de ziekte onder controle te houden en de ziekenhuizen niet te overstelpen. Daarom wordt het beleid steeds bijgesteld wanneer er nieuwe informatie beschikbaar is over het aantal infecties in Nederland.
Dit ‘Corona nummer’ van de Nederlandse Vereniging van Immunologie beschrijft de informatie over het SARS-CoV-2 virus en het afweersysteem zoals dit bekend was in begin april 2020.
Voor de meest recente informatie over het SARS-CoV-2 virus en COVID-19:
Voor meer informatie over vaccineren:Zie https://rijksvaccinatieprogramma.nl/
Voor meer informatie over het afweersysteem: Zie https://mijnafweer.nl
Het Coronavirus
Een virus is geen cel, maar bestaat uit een beetje erfelijk (of genetisch) materiaal omgeven door een omhulsel van vetten en eiwitten. Het zijn microscopisch kleine deeltjes, die zo klein zijn dat ze niet met een gewone microscoop te zien zijn, maar alleen met een zogenaamde elektronenmicroscoop. Gemiddeld zijn virussen 100x kleiner dan een bacterie. Coronavirussen danken hun naam aan hun uiterlijk. Ze hebben regelmatig gerangschikte uitsteeksels, waardoor het lijkt alsof ze een kroontje dragen (kroon = corona in het Latijn). Virussen hebben een gastheer nodig om te overleven.
Er zijn veel verschillende coronavirussen, die meestal vogels en zoogdieren besmetten. Vleermuizen zijn opvallend vaak besmet en een gastheer voor coronavirussen. Ook van het coronavirus dat de huidige pandemie veroorzaakt, wordt gedacht dat de natuurlijke gastheer een vleermuis is, namelijk de hoefijzerneusvleermuis. Het is mogelijk dat het virus via het Javaanse schubdier is overgesprongen, waarmee het vervolgens op de Huanan Seafood markt in Wuhan (China), waar het schubdier verhandeld wordt, bij mensen terecht is gekomen.
Het nieuwe virus heet SARS-CoV-2. De ziekte die dit veroorzaakt heet COVID-19
Tot nu toe zijn er zes coronavirussen gevonden die mensen kunnen infecteren. Dit zijn onder andere SARS en MERS, die de oorzaak waren van epidemieën in 2003 en 2012. Omdat dit nieuwe coronavirus erg lijkt op SARS (dat officieel wordt aangeduid als SARS-CoV), is de officiële aanduiding van het nieuwe virus SARS-CoV-2. Coronavirussen infecteren over het algemeen de hogere luchtwegen en het maagdarm- kanaal. Dit gaat meestal gepaard met milde klachten, zoals verkoudheid, keelpijn, hoest, lichte koorts of diarree. Sommige varianten, zoals MERS, SARS-CoV en SARS-CoV-2 infecteren ook de lagere luchtwegen (de longen) en kunnen levensbedreigende luchtweginfecties en longontsteking veroorzaken. De longziekte die SARS-CoV-2 veroorzaakt, wordt COVID-19 genoemd.
Een virus is afhankelijk van een gastheercel voor vermenigvuldiging
Een virus kan DNA of RNA als genetisch materiaal hebben, maar is volledig afhankelijk van een gastheercel om zichzelf te vermenigvuldigen. Menselijke cellen bevatten DNA, de genetische code van het leven. De volgorde van het DNA bepaalt welke eiwitten worden
geproduceerd. Dit gaat echter niet rechtstreeks, maar via een tussenstap, het RNA. Een virus kan zijn genetische materiaal in menselijk genetisch materiaal integreren, ongeacht of het DNA of RNA bevat.
Stap 1 is de binding van een virusdeeltje aan een cel. Hiervoor misbruikt het virus een herkenningsmolecuul dat op de gastheercel zit. Dit wordt ook wel een receptor genoemd en heeft in onze cellen een heel andere functie. Het virus heeft zich echter zodanig aangepast (=gemuteerd), dat het heel specifiek aan het herkenningsmolecuul op de gastheercel kan binden. De uitsteeksels van het SARS-CoV-2 virus binden aan een herkenningsmolecuul (= ACE-2 receptor) dat o.a. op cellen in de long en darmen zit. Via deze weg kan het virus binnendringen en kaapt het de cel.
Stap 2 is de injectie van het genetisch materiaal in de gastheercel. In het geval van het SARS-CoV-2 virus is dit een enkele streng RNA. De gastheercel ziet dit aan voor het eigen RNA en gaat het vermenigvuldigen. Ook worden er nu viruseiwitten gemaakt (stap 3). Uit deze nieuwe kopieën van het RNA en de viruseiwitten worden nieuwe virusdeeltjes samengesteld. Dit leidt meestal tot de dood van de gastheer- cel. Hierdoor komen de nieuwe virussen vrij en worden nabijgelegen gastheercellen geïnfecteerd, waardoor de ziekte zich exponentieel verder kan ontwikkelen.
Symptomen van een infectie met SARS-CoV-2 zijn zeer variabel
Symptomen treden gemiddeld tussen de vijf dagen en twee weken na besmetting op. De tijd dat iemand al wel geïnfecteerd, maar nog niet ziek is, wordt de incubatietijd genoemd. De symptomen van een infectie met het SARS- CoV-2 virus zijn erg variabel. Tot nu toe lijkt het erop dat minstens acht van de tien mensen milde klachten hebben, zoals droge hoest, keelpijn en/of koorts, vermoeidheid en spierpijn. Darmklachten zoals misselijkheid en diarree kunnen voorkomen en sommige zieken hebben veel hoofdpijn. Meestal zijn de klachten binnen vijf dagen voorbij en worden mensen vanzelf beter. Er zijn ook mensen die geen of nauwelijks klachten hebben. Er zijn aanwijzingen dat deze groep groter is dan gedacht, maar dat is op dit moment lastig aan te tonen door gebrek aan testen.
Het kan dus zijn dat mensen met hele lichte klachten niet weten dat ze besmet zijn. Hierdoor worden ze niet getest en hun aantal wordt niet meegenomen in de tellingen van het RIVM. Ongeveer twee op de tien patiënten krijgen ernstige klachten, zoals benauwdheid en longontsteking. Dat gebeurt meestal pas na een dag of zes van de ziekte. Het is dus belangrijk om juist in deze periode goed op te letten of een zieke meer of minder ziek wordt. De toestand van ongeveer een kwart van deze patiënten kan namelijk zoveel verslechteren dat ze naar het ziekenhuis moeten. Dat gebeurt onder andere als patiënten boven de 40 graden koorts krijgen of heel benauwd worden. De situatie kan bij een deel van de patiënten zelfs kritiek worden, omdat zij ernstige ademhalingsproblemen ontwikkelen. Dit heet het acute respiratoire distress syndroom (ARDS). Deze patiënten moeten worden opgenomen op een intensive care (IC) afdeling, waar ze beademd moeten worden. Beademing kan wel tot drie weken duren voordat patiënten langzaam beter worden. Helaas overlijdt ook een aantal mensen aan de ziekte.
Het sterftecijfer hangt af van eigenschappen van het virus én andere factoren
Het is moeilijk vast te stellen hoe dodelijk het virus is zolang de pandemie nog gaande is. Het sterftecijfer (in officiële termen case-fatality-ratio (CFR)) is ook niet hetzelfde in alle landen. Gedeeltelijk komt dit doordat niet precies bekend is hoeveel mensen de infectie echt hebben. Sommige landen testen heel veel, terwijl andere landen, zoals Nederland, vooral de patiënten testen die zo ziek zijn dat ze naar het ziekenhuis komen. Wanneer niet bekend is hoeveel mensen totaal besmet zijn geraakt, is het sterftecijfer ook niet uit te rekenen. Volgens de laatste schattingen is het sterftecijfer (of CFR) ongeveer 1,2%. Dit zou betekenen dat ongeveer één op de honderd besmette mensen overlijdt aan de infectie. Dit is waarschijnlijk een overschatting, omdat de mensen die géén of lichte symptomen hebben en niet weten dat ze met het SARS-CoV-2 virus besmet zijn, niet worden meegeteld. Op dit moment is onduidelijk over hoeveel mensen dit gaat, wat alle berekeningen en schattingen moeizaam maakt.
Naast de eigenschappen van het virus hangt de dodelijkheid ook van andere factoren af. De samenstelling en gezondheid van de bevolking van een land vóór de uitbraak hebben een grote invloed. Vooral ouderen en mensen die andere chronische gezondheidsproblemen hebben, zoals hart- en vaatziekten, diabetes of luchtwegproblemen, overlijden vaker aan de ziekte COVID-19. Mensen met obesitas hebben waarschijnlijk een groter risico op een IC opname, terwijl kinderen en jonge mensen minder risico op overlijden hebben, ofschoon ze wel (ernstig) ziek kunnen worden. Bij de ziekenhuisopnames en IC opnames zien we helaas veel mensen in de leeftijd van 30-50 jaar.
Daarnaast is de kwaliteit en capaciteit van de gezondheidszorg in een land bepalend voor de afloop. Het sterftecijfer zal lager zijn in een land met een goede gezondheidszorg en relatief jonge gezonde mensen. Het is bovendien heel belangrijk dat er geen situatie ontstaat waarbij de ziekenhuizen overspoeld worden met patiënten, zodat de zorg niet meer optimaal is. Dit laatste is al een probleem in verschillende landen en is een grote bedreiging voor alle landen.
Het SARS-CoV-2 virus wordt vooral overgedragen van de ene op de andere mens. Via kleine druppeltjes, door hoesten en niezen van een besmet persoon, komt het virus in de lucht en wanneer andere mensen die druppeltjes inademen, kunnen zij besmet raken met het virus. Daarnaast kan het virus via de handen in de mond, neus of ogen terecht komen. Hoe zieker iemand is, hoe meer virus iemand kan verspreiden door veel te hoesten en te niezen. Toch lijkt dit nieuwe virus zich ook te kunnen verspreiden wanneer mensen nog niet zoveel symptomen hebben. Nu het duidelijker begint te worden dat er een (grote) groep mensen is, die geen symptomen heeft, maar wel onbewust de ziekte verspreidt, lijkt dit een extra verklaring te zijn waarom de pandemie zich zo snel uitbreidt. Maar hoe groot deze groep is (de laatste schattingen suggereren 25%) en wat de precieze bijdrage is aan de verspreiding moet nog verder worden uitgezocht. Ook is het onduidelijk wat de bijdrage is van het virus dat zich op voorwerpen bevindt. Het is wel duidelijk dat afhankelijk van het materiaal (papier, plastic, metaal) het virus nog uren tot dagen aanwezig kan zijn.
Het vermeerderingsgetal R geeft de besmettelijkheid van een virus aan
Virologen geven de besmettelijkheid van een virus aan met een vermeerderingsgetal. Bij het begin van de uitbraak wordt dat R0 genoemd en bij SARS-CoV-2 is dit geschat op 2,2. Dat betekent dat elke besmette persoon gemiddeld 2,2 andere mensen besmet. De R0 waarde gaat uit van de beginsituatie wanneer er nog geen maatregelen zijn genomen en iedereen vatbaar is. Gedurende de uitbraak kan dit getal veranderen en wordt dan geen R0 meer genoemd, maar Rt wat staat voor het effectieve besmettingsgetal. Wanneer de R0 of Rt groter is dan 1 neemt het aantal
besmettingsgevallen exponentieel toe. Hoe hoger de R, hoe sneller de groei. Als R bijvoorbeeld 2 is, besmet elke persoon 2 anderen, die opnieuw 2 mensen besmetten (van 2 naar 4
naar 8 naar 16 enzovoort). Bij 3 gaat het al veel sneller (3, 9, 27, 81….). Bij een R lager dan 1 zal de infectie langzaam uitdoven. Het is dus belangrijk om maatregelen te nemen, zoals handen wassen, afstand nemen en thuis blijven zodat het vermeerderingsgetal omlaag gaat.
Door de genomen maatregelen gaat R naar beneden
In Nederland lijken deze maatregelen effect te hebben en is de Rt aan het dalen. Het RIVM heeft op 1 april 2020 gepubliceerd dat de Rt in een paar weken tijd gedaald is tot onder de 1. Dat is hoopvol. Omdat mensen al eerder besmet geraakt kunnen zijn, is het mogelijk dat op korte termijn nog steeds veel mensen opgenomen moeten worden in het ziekenhuis, of dat er veel mensen overlijden. Maar hopelijk gaan die getallen ook omlaag op korte termijn. Het is in elk geval al zo dat het aantal ziekenhuisopnames niet zo snel meer toeneemt als in het begin van de pandemie. Het is wel belangrijk om de maatregelen voorlopig vol te houden, want anders zal het aantal besmettingen ook weer snel kunnen toenemen.
Hou afstand en blijf zoveel mogelijk thuis
De belangrijkste besmettingsroute tussen mensen is via uitgehoeste of genieste druppeltjes met virusdeeltjes. De beste manier om dit risico te verlagen, is afstand houden van elkaar (minimaal 1,5 meter) en contact te vermijden. Daarom moeten mensen thuis blijven wanneer zij verkoudheids- klachten hebben zoals niezen, keelpijn, hoesten of koorts. Maar ook voor gezonde mensen geldt dat zij zoveel mogelijk thuis moeten werken en sociale contacten met anderen moeten vermijden, zeker wanneer iemand in een risicogroep valt (ouderen en/of mensen met een chronische ziekte).
Over het nut en de noodzaak van mondkapjes is veel discussie. Wanneer iemand besmet is, zouden mondkapjes verspreiding van druppeltjes kunnen voorkomen. Zelf een mondkapje dragen om niet besmet te raken, heeft – afhankelijk van het type mondkapje – minder effect. Zeker de papieren mondkapjes sluiten niet goed af en kunnen virusdeeltjes doorlaten. Daarnaast kan ook via de ogen besmetting optreden. Zelfs professionele mondkapjes kunnen het risico op besmetting juist verhogen, wanneer ze niet goed gebruikt worden. Daarom wordt in Nederland vooralsnog alleen aan medisch personeel geadviseerd om mondkapjes te dragen.
Handen wassen met zeep verlaagt het risico op besmetting
Wanneer een geïnfecteerde persoon niest of hoest, kunnen virusdeeltjes zowel op eigen handen als op deurkrukken, kranen, winkelwagentjes en andere voorwerpen komen. Daarom is het advies om in de elleboog te hoesten of te niezen, géén handen te schudden en juist wel vaak handen te wassen met zeep. Het aanraken van het gezicht met handen waarop virusdeeltjes zitten, kan namelijk ook voor besmetting zorgen. Het beste is om handen met zeep te wassen, omdat dit de vetten van het virus oplost en het virus uit elkaar valt. Het is wel belangrijk om de handen lang genoeg te wassen (minimaal 20 seconden) zodat de zeep goed kan inwerken. Ook moeten alle onderdelen van de handen (inclusief nagels) en polsen goed gewassen worden.
Het afweersysteem is als een leger
De lymfklieren zijn de kazernes, de bloedvaten en de lymfvaten zijn de wegen die ze met elkaar verbinden.
Het afweersysteem is een verzamelnaam voor een uitgebreid verdedigingssysteem dat bestaat uit vele verschillende moleculen, afweercellen en weefsels. Het is te vergelijken met een leger. Een leger bestaat uit verschillende onderdelen, waarin iedereen een specifieke functie en taak heeft. Veel afweercellen zijn verzameld op speciale plekken in het lichaam, zoals in de lymfeklieren, de milt en het beenmerg. Dit is te vergelijken met kazernes. Zoals kazernes met elkaar zijn verbonden door een wegennet, waarover de troepen zich kunnen verplaatsen, staan de lymfeklieren met elkaar in contact via de lymfevaten. De bloedvaten zijn een tweede wegennet, dat ook in contact staat met de lymfevaten. Afweercellen gebruiken deze twee netwerken om door het lichaam te patrouilleren, zodat ze klaar staan om aan te vallen als een ziekteverwekker binnendringt en om te beschermen tegen ontspoorde (kanker)cellen.
Net zoals een leger een landmacht en een luchtmacht kan hebben, kan het afweersysteem grofweg worden verdeeld in twee grote onderdelen. Dit zijn het aangeboren en het aangeleerde (of verworven) afweersysteem.
Het aangeboren afweersysteem staat altijd paraat, maar heeft geen geheugen
Het aangeboren afweersysteem staat altijd direct klaar en werkt snel. Het wordt ook wel het aspecifieke afweersysteem genoemd, omdat het op alle indringers reageert en niet specifiek op een bepaalde ziekteverwekker. Dit onderdeel heeft geen geheugen. Voor het aangeboren afweersysteem is er geen verschil in de afweerreactie wanneer iemand voor de tweede of derde keer met dezelfde ziekteverwekker in aanraking komt.
Het aangeboren afweersysteem bestaat uit allerlei afweereiwitten en verschillende typen afweer- of witte bloedcellen. Belangrijke cellen van het aangeboren afweersysteem zijn monocyten, macrofagen, granulocyten, ‘natuurlijke killer’ cellen en dendritische cellen. Zij hebben allemaal verschillende functies, die soms ook wel enigszins overlappen. Granulocyten zijn erg goed in het bestrijden van bacteriële en schimmelinfecties. Bij virusinfecties zijn vooral de macrofagen, ‘natuurlijke killer’ cellen en dendritische cellen betrokken.
Macrofagen zitten in alle weefsels en staan als het ware op wacht. Macrofagen kunnen worden omschreven als ‘grote eters’, omdat ze effectief bacteriën, schimmels en virussen opeten en afbreken. Dit gebeurt door een proces dat fagocytose wordt genoemd. Macrofagen (en de meeste granulocyten) behoren dan ook tot de fagocyterende afweercellen. Macrofagen kunnen ook informatie doorgeven aan andere afweercellen. Dit doen ze door signaalstoffen af te geven, als een soort vuurtorens, die andere afweercellen de juiste weg wijzen.
‘Natuurlijke killer’ cellen herkennen cellen die geïnfecteerd zijn met een virus en geven dan instructies aan deze cel om zichzelf te vernietigen. Omdat een virus afhankelijk is van een gastheercel om zichzelf te vermenigvuldigen, is het gunstig als de gastheercel zichzelf vernietigt, omdat hiermee ook het virus te gronde wordt gericht.
Dendritische cellen lijken op macrofagen en staan ook op wacht in de weefsels. Maar hun belangrijkste functie is niet om veel ziekteverwekkers op te eten, maar ze als het ware te proeven. Vervolgens kunnen ze via de snelwegen in ons lichaam op weg gaan naar de lymfeklieren en de informatie
doorgeven aan de cellen van het aangeleerde afweer- systeem (de lymfocyten). Ze kunnen daarom worden gezien als boodschappers en dirigenten van het afweersysteem omdat ze de lymfocyten van de juiste informatie voorzien en aansturen.
Het aangeleerde afweersysteem is heel specifiek en heeft geheugen
In tegenstelling tot het aangeboren afweersysteem is het aangeleerde afweersysteem juist heel specifiek en ontwik- kelt het geheugencellen. Het is wel langzamer en heeft ongeveer 7-10 dagen nodig om goed te ontwikkelen als iemand voor de eerste keer in aanraking komt met een ziekteverwekker. Maar daarna is de bescherming tegen dezelfde ziekteverwekker langdurig en in sommige gevallen zelfs levenslang. Dat wil niet zeggen dat iemand niet meer ziek kan worden van deze specifieke ziektekiem, maar als het aangeleerde afweersysteem opnieuw wordt geactiveerd, is de beschermende werking sneller en zal iemand minder ziek worden dan de eerste keer. Dit deel van de afweer heeft iemand nog niet bij de geboorte, omdat men eerst in aanraking geweest moet zijn met een ziekteverwekker om geheugencellen te kunnen aanmaken. Dit moet voor elke nieuwe ziekteverwekker opnieuw ontwikkeld worden. Het aangeleerde afweersysteem wordt dus gedurende het hele leven opgebouwd.
Cellen van het aangeleerde of adaptieve afweersysteem worden lymfocyten genoemd. Lymfocyten reageren heel specifiek doordat ze indringers kunnen herkennen met behulp van bepaalde herkenningsmoleculen op hun oppervlakte. Deze herkenningsmoleculen, of receptoren, herkennen heel precies een klein stukje van de indringer. Dit is ook wel te vergelijken met een sleutel-slot reactie. Het slot gaat alleen open als de juiste sleutel past. Een lymfocyt die bijvoorbeeld een receptor heeft voor een molecuul van een griepvirus, zal niet reageren op een Salmonella infectie en vice versa. Lymfocyten kunnen zich ontwikkelen tot een geheugencel. Als ze eenmaal een bepaalde indringer hebben gezien, reageren ze sneller als deze opnieuw het lichaam probeert binnen te dringen. Dit heeft het grote voordeel dat een persoon die een bepaalde ziekte heeft gehad de tweede keer niet of minder ziek wordt.
Er zijn twee soorten lymfocyten die T cellen en B cellen worden genoemd. T cellen kunnen verder onderverdeeld worden in killer T cellen en helper T cellen. Killer T cellen zijn
de scherpschutters van het afweersysteem. Ze kunnen virus- geïnfecteerde en ontspoorde (kanker) cellen herkennen en geven dan heel gericht instructies aan de cel om zichzelf te vernietigen. Qua functie lijken ze dus op de ‘natuurlijke killer’ cellen. De helper T cellen kunnen andere afweercellen alarmeren en activeren als dat nodig is. Wanneer een B cel wordt geactiveerd, gaat deze antilichamen uitscheiden. De B cel wordt als het ware een munitiefabriek.
Antilichamen worden ook wel antistoffen of immuunglobulinen genoemd. Antistoffen hebben twee verschillende kanten. De ene kant (de ‘kop’) is heel specifiek gericht tegen een molecuul (antigeen) dat op een ziekteverwekker zit. De andere kant van de antistof (de ‘staart’) bindt aan een groep herkenningsmoleculen die voorkomen op afweercellen, zoals macrofagen. Door met de ‘kop’ te binden aan het antigeen op de ziektekiem en via de ‘staart’ aan de herkenningsmoleculen op de afweercellen, vormen antistoffen als het ware een brug. Hierdoor wordt de afweercel geactiveerd en de ziektekiem opgeruimd.
Antistoffen zitten in moedermelk om een pasgeboren baby te beschermen tegen ziektekiemen. Tegenwoordig kunnen antistoffen ook geïsoleerd worden uit bloed van gezonde vrijwilligers waarna ze als behandeling worden gegeven aan patiënten die zelf te weinig antistoffen maken. Dit wordt intraveneuze immuunglobulinen (IVIG) genoemd. Tenslotte worden tegenwoordig ook antilichamen in het laboratorium gemaakt als behandeling tegen infecties en kanker.
Interferon speelt een belangrijke rol bij virusinfecties
Vlak na een infectie ontstaat een stortvloed aan reacties. Bij een virusinfectie speelt de productie van het signaal- molecuul interferon een grote rol. Dit wordt geproduceerd door cellen die zijn geïnfecteerd door het virus. Interferon doet twee belangrijke dingen. Aan de ene kant bemoeit het zich (interfereert) met de vermenigvuldiging van het virus. Daar is de naam interferon van afgeleid. Aan de ander kant activeert interferon bepaalde cellen van het afweersysteem zoals de macrofagen en de ‘natuurlijke killer’ cellen die de ziekteverwekkers aanvallen. De dendritische cellen dragen ook hun steentje bij. Ze ‘proeven’ de infectie en migreren dan naar de lymfeklieren waar ze de informatie doorgeven aan de lymfocyten.
Sommige ziekteverwekkers scheiden bepaalde giftige stoffen (toxines) uit, die koorts opwekken. Koorts- verwekkende stoffen kunnen ook worden uitgescheiden door afweercellen als reactie op de infectie. Koorts helpt om de infectie te bestrijden, omdat het de groei van bepaalde ziekteverwekkers tegengaat. Ook gaat ons afweersysteem er harder door werken. Helaas zorgt koorts er ook voor dat iemand zich heel erg ziek kan voelen. Als de ziekte langer duurt dan een paar dagen, komt het aangeleerde afweer- systeem in actie. De lymfocyten in de lymfeklieren hebben informatie gekregen van de dendritische cellen en gaan zich vermenigvuldigen om de ziekteverwekkers te bestrijden. Hierdoor zwellen de lymfeklieren op, wat bijvoorbeeld vaak goed te voelen is bij een keelontsteking.
Het SARS-CoV-2 virus is nieuw voor mensen. Daarom heeft nog vrijwel niemand weerstand opgebouwd. Alleen mensen die in de afgelopen maanden zijn blootgesteld aan het SARS- CoV-2 virus én de infectie hebben overleefd, hebben waar- schijnlijk een beschermende afweerreactie opgebouwd. Maar alle andere mensen zijn onbeschermd. Daarom kan het virus zich zo snel verspreiden en is de pandemie ontstaan. Dit is een groot verschil tussen bijvoorbeeld SARS-CoV-2 en griep (Influenza).
Het afweersysteem van verschillende patiënten reageert verschillend op het SARS-CoV-2 virus
Het verloop van de ziekte varieert van patiënt tot patiënt. Bij de meeste (de schatting is 80-85%) mensen voelt het aan als verkoudheid of milde griep, terwijl andere mensen (15-20%) ernstige longontsteking ontwikkelen en weken aan de beademing liggen of overlijden. Op dit moment is nog te weinig van het virus bekend om precies te begrijpen waarom de ene persoon ziek wordt en de ander niet. Maar wat vergelijkbaar is met andere typen infecties is dat de reactie van het afweersysteem erg verschillend is bij verschillende patiënten. Dit speelt waarschijnlijk een grote rol in het verloop van de ziekte.
Een normale afweerreactie is heel gebalanceerd. Het Kedzierska Lab in Melbourne heeft de afweerreactie en de afweercellen van een patiënt met een milde SARS-CoV-2 infectie onderzocht. In deze patiënt werden snel verschillende onderdelen van de afweer geactiveerd, zoals ook bij andere infecties wordt gezien. Bij een milde infectie
lijkt het afweersysteem dus normaal te reageren, waardoor de zieke persoon beter wordt. Het is niet nog niet helemaal duidelijk hoe het afweersysteem reageert bij ernstig zieke mensen. Het lijkt er op dat het afweersysteem bij deze patiënten juist te sterk reageert en op hol slaat. In die gevallen worden veel te veel signaalstoffen geproduceerd, die heel veel schade aanrichten aan weefsels en ontsteking in de longen geven. Dit wordt ook wel een cytokinestorm genoemd en zou kunnen verklaren waarom de toestand bij sommige patiënten in een korte tijd kan verslechteren. Er ontstaat in dit geval een ernstige ontstekingsreactie waardoor het slijmvlies in de longblaasjes dikker wordt. Hierdoor wordt het lastiger om zuurstof op te nemen en in de bloedbaan te krijgen. De longen vullen zich bovendien met vocht en pus (= dode afweercellen) en ademhalen wordt steeds moeilijker. Waarom het afweersysteem opeens op hol slaat is nog onbekend, maar wordt vaker gezien als reactie op een ziekteverwekker van de luchtwegen. Bij bijvoorbeeld de Spaanse griep was dit ook het geval bij ernstig zieke patiënten.
Vrouwen hebben vaker een betere afweer
Vrouwen lijken beter op de infectie te reageren dan mannen. Gemiddeld zijn twee van de drie patiënten met ernstige symptomen man. Vrouwen hebben over het algemeen een betere afweer. Dit komt waarschijnlijk omdat de regulatie van de afweerreactie onder andere wordt geregeld door het X-chromosoom. En omdat vrouwen twee X-chromosomen hebben en mannen maar één, is de afweer van vrouwen beter gereguleerd dan bij mannen. Overgewicht lijkt een negatieve rol te spelen. De onderliggende mechanismen zijn nog onbekend, maar verschillende studies hebben een relatie aangetoond tussen overgewicht en een verstoorde werking van het afweersysteem. Wanneer kinderen geïnfecteerd raken met het SARS-CoV-2 virus, is de kans dat ze ziek worden verrassend klein. Meestal krijgen ze óf geen óf hele milde symptomen. Er zijn maar weinig kinderen die op de intensive care belanden, ofschoon er wel uitzonderingen zijn. Toch is het duidelijk dat kinderen beter op de infectie reageren dan volwassenen. Mogelijk hebben kinderen meer aangeboren afweercellen die betrokken zijn bij de bestrijding van een SARS-CoV-2 infectie. Het kan echter ook zo zijn dat kinderen minder aanhechtings- moleculen hebben op darm- en longcellen.
Groepsbescherming
Een belangrijke reden wat het SARS-Cov-2 virus zo gevaarlijk maakt, is dat het nieuw is voor mensen. Hierdoor heeft nog vrijwel niemand weerstand (= immuniteit) opgebouwd. Iedereen is vatbaar voor infectie met dit virus, waardoor het zich ongehinderd kan verspreiden en veel slachtoffers maakt.
Groepsbescherming of kudde-immuniteit beschermt de kwetsbare mensen in de samenleving
Groepsbescherming of kudde-immuniteit, kan kwetsbare mensen in een samenleving beschermen tegen ernstige ziektes, zoals SARS-CoV-2. Wanneer heel veel mensen in een gemeenschap immuun zijn voor een bepaalde ziekteverwekker, wordt de verspreiding snel gestopt. Een niet-immuun persoon kan weliswaar zelf ziek worden, maar kan geen immune personen in de omgeving besmetten en de ziekte zal uitdoven. Hierdoor wordt het risico op infectie voor kwetsbare mensen fors verlaagd.
Hoeveel mensen in de maatschappij immuun moeten zijn voor effectieve groepsbescherming hangt af van het vermeerderingsgetal (R). Bij een erg besmettelijke ziekte- verwekker moeten meer mensen immuun zijn dan bij een minder besmettelijke ziekteverwekker. Mazelen is bijvoor- beeld een zeer besmettelijke ziekte. Eén ziek persoon kan wel tot 18 andere mensen besmetten (R0=18). Als nog niemand immuun zou zijn, kan mazelen zich angstwekkend snel verspreiden (van 18 personen naar 364 naar 5.832 naar 104.976 enzovoort).
Met behulp van de R kan worden uitgerekend hoeveel mensen immuun moeten zijn om goede groepsbescherming te hebben. Als vuistregel geldt dat er geen epidemie kan optreden als het percentage immune mensen hoger is dan ((R0-1)/R0) x 100%. Voor mazelen is dat ((18-1)/18) x 100% = ongeveer 94%. De groepsbescherming komt in gevaar als dat percentage lager wordt. Daarom is het zorgwekkend dat de vaccinatiegraad voor mazelen de laatste jaren is gedaald. Voor SARS-CoV-2 met een geschatte R0 van 2,2 geldt dat ((2,2-1)/2,2) x 100% = ongeveer 55% van de mensen immuun moeten zijn om de pandemie te stoppen. Er wordt een iets ruimere marge aangehouden en daarom gaat men ervan uit dat groepsbescherming optreedt als 60% van de mensen immuun is. Wanneer het lukt het aantal besmettingen te verlagen (het vermeerderingsgetal gaat omlaag) door maatregelen te nemen, zijn minder mensen met weerstand nodig om dit te bereiken.
Elk land neemt maatregelen afhankelijk van de situatie in dat land
Over de hele wereld nemen landen maatregelen om de pandemie te stoppen. Hier zijn verschillende scenario’s voor. Scenario 1 is niets doen om zo snel mogelijk groeps- bescherming te krijgen. Deze aanpak heeft het voordeel dat iedereen wordt blootgesteld en de 60% mensen met weerstand het snelst wordt bereikt. Dit zou echter wel gepaard gaan met een groot verlies aan mensenlevens. Het Verenigd Koninkrijk was bijvoorbeeld in eerste instantie van plan om voor dit scenario kiezen, totdat duidelijk werd dat dit zou betekenen dat in een korte tijd bijna 40 miljoen mensen ziek zouden worden, waarvan 8 miljoen ernstig. De gezondheidszorg en met name intensive care afdelingen zouden volkomen overspoeld raken met patiënten en dit zou tot een zorginfarct leiden waardoor honderdduizenden patiënten zouden komen te overlijden.
Scenario 2 doet precies het tegenovergestelde door het land een zogenoemde lock-down op te leggen en mensen te verbieden hun huis te verlaten. Het voordeel van deze aanpak is dat het aantal besmettingen zoveel mogelijk wordt beperkt op korte termijn. Een risico is echter dat de tijd als het ware wordt bevroren en er helemaal geen groepsbescherming wordt opgebouwd. Zodra de lock-down wordt opgeheven, is de situatie niet veranderd en hoeft er maar één besmet persoon het land binnen te komen om weer van voren af aan te beginnen.
De meeste landen kiezen voor een tussenweg. Hierbij wordt uitgegaan van modellen die uitrekenen wat het verwachte aantal ziekenhuisopnames en intensive care opnames wordt in dat land. Vervolgens wordt bepaald welke maatregelen ervoor zorgen dat de maximum capaciteit van de ziekenhuizen niet wordt overschreden. Daardoor kan het zo zijn dat een land met weinig infecties minder maatregelen hoeft te nemen dan een land met veel infecties. Ook kan het zo zijn dat de maatregelen aangescherpt moeten worden als het aantal infecties toeneemt in een land met tot dan toe weinig infecties. Dit beleid wordt meestal aangeduid met de Engelse term “flatten the curve” en moet ervoor zorgen dat de voorspelde golf van infecties onder de grens van de maximaal mogelijke ziekenhuisopnames blijft. Italië, Frankrijk en Spanje hebben bijvoorbeeld voor een lock-down gekozen, terwijl Zweden juist kiest voor een aanpak die dichter tegen scenario 1 aan ligt, omdat er nog weinig besmettingen zijn. Universiteiten zijn gesloten en grote publieke evenementen zijn verboden, maar de horeca, scholen, winkels en sportscholen zijn nog wel gewoon open. Niemand weet op dit moment wat de beste aanpak is. Ook dat zal pas achteraf duidelijk worden.
In Nederland is voor een ‘intelligente lock-down’ gekozen en wordt aan burgers gevraagd hun eigen verantwoordelijk- heid te nemen. Men moet zo veel mogelijk thuiswerken, zo min mogelijk naar buiten gaan als het niet nodig is en niet met meer dan 3 mensen bij elkaar op bezoek gaan. Scholen zijn gesloten en er is een groepsverbod voor meer dan 2 personen. Het doel van dit beleid is niet per se om groepsimmuniteit te bereiken, maar om het aantal besmettingen over de tijd uit te smeren. Hierdoor wordt hopelijk niet iedereen tegelijk ziek, zodat de IC afdelingen niet overbelast raken. Een bijkomend voordeel is dat langzaam groepsimmuniteit zal ontstaan. Vanzelfsprekend wordt de situatie nauwlettend in de gaten gehouden en zullen maatregelen worden aangescherpt als óf het aantal besmettingen niet snel genoeg daalt óf als mensen de voorgeschreven maatregelen onvoldoende opvolgen.
Het is buitengewoon lastig om te voorspellen hoe lang het duurt voordat groepsimmuniteit wordt bereikt. Op dit moment wordt er, op basis van de huidige cijfers en modellen, vanuit gegaan dat ongeveer 60% van de mensen besmet moet zijn geraakt en weerstand moet hebben
Nederland heeft gekozen voor een ‘intelligente lockdown’
opgebouwd. Het probleem is dat het nog onbekend is hoeveel mensen besmet zijn geraakt met SARS-CoV-2. Er zijn aanwijzingen dat er mensen zijn die wel geïnfecteerd zijn geweest, maar nauwelijks symptomen hebben. Het zou goed nieuws zijn als dit om veel mensen gaat, omdat groepsbescherming dan sneller wordt bereikt. Als dit echter maar een paar mensen zijn, gaat dit niet helpen. Het is ook nog niet duidelijk hoe lang mensen immuun blijven tegen SARS-CoV-2. Van mildere varianten van het coronavirus, die slechts verkoudheid veroorzaken, is bekend dat mensen maar ongeveer een jaar beschermd zijn. Het is onbekend of dit hetzelfde is bij de agressievere SARS-CoV-2 variant. Als mensen inderdaad na een jaar weer vatbaar zijn, duurt het langer voordat groepsimmuniteit wordt bereikt. De beschikbaarheid van een vaccin (zie blz. 22) zou het bereiken van groepsimmuniteit enorm versnellen.
Het testen van iedereen die verkoudheidsklachten heeft, zou een beter beeld geven van het aantal mensen dat besmet is met het SARS-CoV-2 virus. Weliswaar zouden nog steeds de mensen zonder symptomen gemist worden, maar het zou toch een beter beeld geven over de verwachte groeps- bescherming. Er zijn echter twee problemen met deze aanpak.
Iedereen testen leidt tot grote tekorten en schijnveiligheid
Het eerste probleem is dat in deze tijd naast SARS-CoV-2 ook griep- en verkoudheidsvirussen heersen. Er zijn heel erg veel mensen met verkoudheidsklachten en de kans dat iemand daadwerkelijk besmet is met het SARS-CoV-2 virus is gelukkig nog klein. Het testen van al deze mensen zou leiden tot grote tekorten. Er is schaarste aan testen en daarom worden voor- namelijk zorgpersoneel, patiënten die opgenomen worden in het ziekenhuis en kwetsbare patiënten buiten zieken- huizen, getest. Om te zorgen dat er genoeg testen beschik- baar blijven voor deze risicogroepen, komen personen met milde klachten niet in aanmerking. Deze mensen moeten thuis uitzieken en in zelfquarantaine gaan, samen met hun familieleden of huisgenoten.
Het tweede probleem is dat geen enkele test foutloos is. Een percentage patiënten zal ten onrechte de uitslag krijgen dat er géén ziekte aanwezig is. Dit is een vals-negatieve score. Tegelijkertijd zullen gezonde mensen ten onrechte de uitslag
‘ziekte’ krijgen (vals-positieve score). De aantallen fout-nega- tieve en fout-positieve scores bepalen de betrouwbaarheid van een test. Aan de ene kant is inmiddels duidelijk dat patiënten een vals-negatieve score kunnen krijgen, terwijl ze twee dagen later wel positief getest worden. Gedurende deze tijd zijn mensen ten onrechte gerustgesteld en nemen ze niet de juiste voorzorgmaatregelen om te voorkomen dat anderen besmet worden. Aan de andere kant zal het massaal testen van mensen met verkoudheidsklachten leiden tot veel vals-positieve resultaten, waardoor er veel onnodige onge- rustheid zal ontstaan. Daarom wordt in Nederland vooral gericht getest, wanneer er al ernstige verdenking is op besmetting met het SARS-CoV-2 virus. Binnenkort beginnen het RIVM en Sanquin wel met een grote steekproef om beter inzicht te krijgen hoe het SARS-CoV-2 virus zich over Nederland heeft verspreid.
Antistoftiter bepaling geeft informatie over het ontstaan van groepsbescherming
Mensen die besmet zijn geweest met het SARS-Cov-2 virus maken antistoffen aan, ook wanneer de symptomen ongemerkt voorbij zijn gegaan. Het aantal antistoffen kan worden bepaald in het bloed en wordt een titerbepaling genoemd. Deze test bepaalt niet of iemand op dat moment geïnfecteerd is, maar of iemand al in aanraking is geweest met het virus. De eerste resultaten suggereren dat de antistoftiter laag is bij mensen met een milde infectie. Door de antistoftiter bij grote groepen mensen te meten, kan men er achter komen hoeveel mensen in de samenleving besmet zijn geraakt met het virus, afweer hebben gekregen en hoe de groepsbescherming zich ontwikkelt. Ook bij deze test zijn de genoemde problemen hetzelfde. Het is goed te begrijpen dat iedereen zo snel mogelijk wil weten of zij besmet zijn geraakt. Maar dit zal tot grote tekorten aan testen leiden. Daarnaast zal deze test ook vals-negatieve en vals-positieve resultaten hebben. Het is daarom belangrijk dat de testen op een gecoördineerde manier worden uitgevoerd.
Het RIVM en Sanquin (de bloedbank) gaan in een steekproef bloed verzamelen van mensen uit het hele land en van alle leeftijdsgroepen. De antilichaamtiter zal bepaald worden op meerdere momenten gedurende een aantal maanden. Door dezelfde mensen meerdere keren te testen, wordt de uitslag betrouwbaarder. Bovendien kan op deze manier onderzocht worden hoe lang antistoffen aanwezig blijven en of ze van goede kwaliteit zijn. Daarnaast wordt in kaart gebracht hoe de groepsbescherming zich in de tijd ontwikkelt in Nederland.
Vaccinatie.
De beste manier om op een veilige manier groepsbescherming te krijgen, is vaccinatie. Het is daarom belangrijk dat er snel een goed vaccin komt tegen SARS-CoV-2.
Een vaccin is van levensbelang
Wat is het principe achter vaccinatie? Normaal gesproken reageert het afweersysteem sneller en sterker wanneer het voor de tweede keer in aanraking komt met dezelfde ziekteverwekker, omdat het geheugen heeft opgebouwd. Hierdoor worden mensen de tweede keer óf helemaal niet ziek óf sneller beter. Dit kan worden nagebootst met vaccinatie. De eerste blootstelling gebeurt dan door het geven van een verzwakte of onschadelijke vorm van de ziekteverwekker. Hier zal het afweersysteem op reageren alsof er een echte infectie is en wordt er immunologisch geheugen opgebouwd, zonder dat mensen echt ziek worden. Wanneer iemand vervolgens in aanraking komt met de echte ziekteverwekker (in dit geval SARS-CoV-2) wordt iemand niet of minder ziek.
Dit geldt natuurlijk niet alleen voor SARS-CoV-2. Dankzij het Rijksvaccinatieprogramma worden kinderen zo goed mogelijk beschermd tegen gevaarlijke ziektes. En hierdoor wordt iedereen, inclusief de kwetsbare mensen in de samenleving, beschermd. Het is daarom alarmerend dat steeds meer mensen denken dat vaccinatie niet nodig of zelfs gevaarlijk is. Hierdoor neemt de vaccinatiegraad tegen ernstige ziektes af en wordt de groepsbescherming bedreigd. De Coronacrisis benadrukt het belang van vaccinaties, die over het algemeen veilig en effectief zijn.
Vaccins zijn geneesmiddelen. Daarom moeten ze aan hele strenge eisen voldoen voordat ze gebruikt mogen worden. Dit wordt gecontroleerd door het College ter Beoordeling van Geneesmiddelen (CBG) en het Europese Genees- middelenagentschap (EMA). De veiligheid en effectiviteit van vaccins worden continue in de gaten gehouden. Zo wordt er bijgehouden hoe vaak en welke bijwerkingen er zijn. Bijwerkingen van vaccinatie zijn meestal mild. De plek van vaccinatie kan rood worden, opzwellen en pijn doen. Ook kortdurende hoofdpijn, moeheid en lichte koorts komen relatief vaak voor. Deze symptomen komen door de activering van het afweersysteem. Heel soms kan het afweersysteem overreageren en kan er een anafylactische shock (hele ernstige allergische reactie) ontstaan. Het risico op ernstige bijwerkingen van een vaccinatie is echter vele malen kleiner dan de infectieziekte.
Op dit moment zijn er veel verschillende initiatieven om een vaccin te ontwikkelen. Waarom geen samenwerking om zo snel mogelijk één vaccin klaar te hebben? Dat heeft natuurlijk ook met bedrijfsbelangen te maken, maar daarnaast is het goed om verschillende dingen uit te proberen. SARS-CoV-2 is nieuw en het is nog niet duidelijk hoe het afweersysteem er op reageert. Niemand weet nog wat de beste manier is om een vaccin te ontwikkelen. Het is natuurlijk wel belangrijk dat de geleerde informatie bekend wordt gemaakt, zodat andere wetenschappers daar van kunnen leren.
Het afweersysteem lijkt normaal te reageren op SARS- CoV-2
SARS-CoV-2 lijkt niet veel te muteren
De eerste berichten lijken in elk geval gunstig. Het onderzoek van het Kedzierska Lab in Melbourne met een eerste COVID-19 patiënt heeft laten zien dat een normale afweerreactie wordt opgewekt in het geval van een milde infectie. Dat suggereert dat vaccinatie ook een afweerreactie zou kunnen opwekken. Daarnaast lijkt SARS-CoV-2 weinig te muteren volgens Peter Thielen, een geneticus aan de Johns Hopkins Universiteit in Baltimore. Ook dat is heel belangrijk voor de ontwikkeling van een goed vaccin. Omdat vaccins heel specifiek zijn, beschermen ze niet goed tegen een ziekteverwekker die is veranderd. Dit is bijvoorbeeld een groot probleem bij griepvaccins, omdat griepvirussen continue muteren en daarmee veranderen. Daarom moeten er elk jaar nieuwe griepvaccins worden ontwikkeld. In het geval van SARS-CoV-2 is hopelijk maar één vaccin nodig, omdat het virus minder veranderlijk is.
Drie verschillende vormen van een vaccin
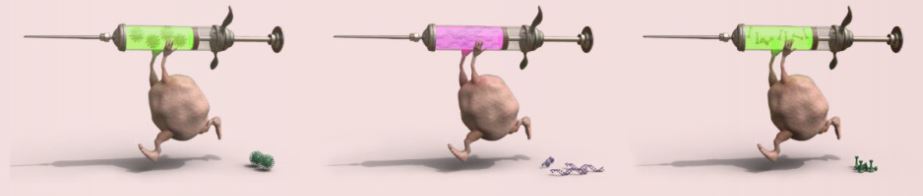
Links: een klassiek vaccin met verzwakte of dode ziekteverwekkers. Midden: het vaccin van Moderna Therapeutics met alleen stukjes RNA. Rechts: het vaccin met geïsoleerde uitsteeksels dat in Wageningen wordt ontwikkeld.
De 1e vrijwilligers zijn gevaccineerd
De eerste vrijwilligers worden inmiddels gevaccineerd. Dit gebeurt op een nieuwe manier. Vroeger bevatten de meeste vaccins een levend, maar verzwakte ziekteverwekker. Hierdoor reageert het afweersysteem goed waardoor gezonde mensen niet worden geïnfecteerd. Dit type vaccins kan echter problemen geven bij mensen bij wie het afweersysteem niet goed werkt of verzwakt is. Om de veiligheid te vergroten worden tegenwoordig vooral geïnactiveerde, dode vaccins gebruikt. Deze bestaan uit stukjes ziekteverwekkers, die zich niet kunnen vermenigvuldigen. Bij dit nieuwe vaccin, ontwikkeld door het bedrijf Moderna Therapeutics, gaat men nog een stap verder. Er zit helemaal geen virus in, maar er wordt slechts een stukje van de genetische code van het virus ingespoten (bij dit virus is dat RNA). Dit stukje RNA codeert voor de virusuitsteeksels dat SARS-CoV-2 gebruikt om de menselijke cel binnen te dringen. Hierdoor gaat het lichaam alleen deze uitsteeksels produceren, maar niet de rest van het virus. En hopelijk wordt ook het afweersysteem geactiveerd, waardoor beschermende antistoffen worden geproduceerd tegen de uitsteeksels. Of dit werkt moet de komende maanden gaan blijken.
De universiteit van Wageningen heeft een iets andere aanpak. Deze onderzoekers hebben een techniek ontwikkeld waarbij insectencellen grote hoeveelheden uitsteeksels produceren. Die kunnen vervolgens geïsoleerd worden en gebruikt worden als vaccin. Het bedrijf Janssen Vaccines Leiden heeft weer een andere aanpak, waarbij gebruik wordt gemaakt van een onschuldig verkoudheidsvirus, waarin een klein stukje RNA van het SARS-CoV-2 virus is ingezet. Naar verwachting wordt dit vaccin in september 2020 voor het eerst in mensen getest. De veiligheid en effectiviteit van deze vaccins moet uitgebreid worden getest, voordat ze breed toegepast kunnen worden. Naar verwachting zal het nog minstens een jaar duren voordat er een vaccin beschikbaar is.
Omdat de ontwikkeling van een vaccin waarschijnlijk nog een tijd duurt terwijl de crisis voortraast, worden ook andere dingen geprobeerd om de ziekte te bestrijden. Zo wordt er bijvoorbeeld bij het Radboud Universitair Medisch Centrum onderzocht of een vaccin tegen tuberculose het afweersysteem versterkt. Dit vaccin zal geen specifieke afweerreactie tegen het SARS-CoV-2 virus opwekken, omdat het gericht is tegen Mycobacterium, dat tuberculose veroorzaakt. Maar dit vaccin bevat een verzwakte levende bacterie die enkele maanden aanwezig blijft na injectie onder de huid. Hierdoor wordt het aangeboren afweersysteem geactiveerd. Uit eerdere studies is gebleken dat dit de weerstand tegen o.a. de griep en malaria versterkt. Nu wordt onderzocht of dit ook helpt bij een SARS-CoV-2 infectie.
Genezende antistoffen
Tijdens een recente Ebola uitbraak is ontdekt dat antistoffen van mensen die genezen waren, gebruikt kunnen worden om patiënten te behandelen. Nu wordt onderzocht of dit ook het geval is bij een SARS-CoV-2 infectie. Daarom is Sanquin begonnen met het verzamelen van bloedplasma van genezen coronapatiënten. Dit gebeurt in nauwe samenwerking met ziekenhuizen, onderzoekers van binnen en buiten Sanquin, de GGD en het RIVM. Het plasma kan vervolgens aan ernstig zieke patiënten worden gegeven in de hoop dat dit de verspreiding van het virus in het lichaam tegengaat en de symptomen worden verlicht. Misschien kan dit zelfs voorkomen dat patiënten moeten worden opgenomen op de intensive care. Op dit moment is de eerste studie begonnen in het Erasmus Medisch Centrum. Ook wordt onderzocht of dit plasma gebruikt kan worden om gezonde mensen die in contact komen met patiënten te beschermen tegen infectie.
Sanquin gaat ook proberen om hier in de toekomst een geneesmiddel van te maken, maar op dit moment is het nog geen algemeen verkrijgbare behandeling voor patiënten met COVID-19. Voorlopig zal het plasma nog schaars zijn totdat er voldoende patiënten genezen zijn.
Antistoffen voorkomen dat het SARS-Cov-2 virus de gastheercel infecteert.
Een ander nadeel van deze behandeling is dat er slechts een tijdelijke bescherming is. Er wordt namelijk geen immunologisch geheugen opgebouwd en de gegeven antistoffen zullen geleidelijk weer uit het lichaam verdwijnen. Maar voor mensen in de zorg, kwetsbare mensen en ouderen zou deze behandeling een uitkomst kunnen zijn.
Antilichamen kunnen tegenwoordig ook in een laboratorium gemaakt worden. Wetenschappers van de Universiteit Utrecht en het Erasmus Medisch Centrum hebben een antilichaam gevonden dat de infectie met SARS- CoV-2 zou kunnen remmen. Dit wordt nu op grote schaal geproduceerd en zal ook in een klinische studie worden getest.
Experimentele virusremmers
Het zal nog een tijdje duren voordat vaccins en antistoffen algemeen beschikbaar zijn. Daarom wordt er gezocht naar alternatieven die het virus af remmen bij COVID-19 patiënten. Er zijn een aantal geneesmiddelen die bewezen effect hebben bij andere infecties. Het middel Remdesivir is getest bij ebolapatiënten en zorgt er voor dat het ebola virus zich niet meer kan vermenigvuldigen. Nu wordt onderzocht of dit geneesmiddel ook de vermenigvuldiging van het SARS- CoV-2 virus kan remmen. Een tweede middel is het malariamiddel chloroquine, omdat gedacht wordt dat dit medicijn het binnendringen van het SARS-CoV-2 virus in de cel zou kunnen remmen. Het behandelen van COVID-19 met deze medicijnen is in beide gevallen nog experimenteel. Omdat deze middelen ook ernstige bijwerkingen kunnen hebben, moet eerst goed onderzocht worden of patiënten daadwerkelijk baat hebben van deze behandeling, voordat het grootschalig kan worden gegeven.
Cytokine storm remmers
Een ander middel dat onderzocht wordt, heet camostat. Dit middel pakt niet het virus aan, maar een aanhechtingsmolecuul op de cel. Als dit medicijn voorkomt dat het virus kan binden en binnendringen, wordt de infectie ook geremd. Een virus is immers afhankelijk van een gastheercel voor vermenigvuldiging. Ook wordt onderzocht of het mogelijk is de ergste symptomen te remmen. Waarschijnlijk is de overvloed aan signaalmoleculen, de zogenoemde cytokine storm, de oorzaak van de ernstige longontsteking bij een aantal patiënten. Er zijn al medicijnen op de markt die sommige van deze signaalstoffen kunnen remmen. Nu wordt onderzocht of dit ook bij COVID-19 werkt.
Tenslotte: Belangrijke punten
- Het SARS-CoV-2 virus is nieuw voor mensen. Daarom is nog niet alles bekend en kan informatie door voortschrijdend inzicht veranderen.
- Symptomen van de infectie zijn zeer variabel. Zelfs mensen zonder symptomen kunnen besmettelijk zijn. Houdt u daarom aan de voorschriften. Blijf zo veel mogelijk thuis, houdt afstand en was uw handen vaak met zeep.
- Door de genomen maatregelen gaat het besmettingsgetal R omlaag. Door het te vroeg opheffen van de maatregelen, kunnen de besmettingen weer snel toenemen. Het is dus zaak om vol te houden.
- Groepsbescherming beschermt de kwetsbare mensen in de samenleving. Vaccinatie versnelt het bereiken van groepsbescherming.
- Let een beetje op elkaar.
Nederlandse Vereniging voor Immunologie (NVVI)
Tekst:
Prof.dr. Marjolein van Egmond, Amsterdam UMC
Illustraties: Prof.dr. Georg Kraal, Amsterdam UMC
Prof.dr. Marjolein van Egmond, Amsterdam UMC Prof.dr. Marieke van Ham, Sanquin
Prof.dr. Georg Kraal, Amsterdam UMC Prof.dr. Reina Mebius, Amsterdam UMC Prof.dr. Annemiek van Spriel, Radboud UMC Dr. Edward Knol, UMC Utrecht
Annelot Breedveld MSc, Amsterdam UMC Saskia ter Braak, UMC Utrecht
Stella uit de Bosch, Amsterdam UMC Mariska van der Zee, Amsterdam UMC
https://www.dutchsocietyimmunology.nl/